中性粒细胞胞外诱捕网促使肾结石形成
中性粒细胞胞外诱捕网促使肾结石形成


2024年11月,中南大学湘雅医院湘雅国际医学中心老年泌尿外科张晓波教授团队于《Kidney Dis (Basel)》 (Q1,IF,3.2)杂志上发布了文章“Neutrophil Extracellular Traps Drive Kidney Stone Formation”。该研究发现:
①西维可明显减轻肾损伤,并通过抑制大鼠 NETs 的形成来抑制肾结石的发展。西维来司他钠能使肾结石大鼠体内增加的钙沉积、凋亡细胞和肾小管损伤均得到改善,能提高肾结石大鼠的 SOD 活性,降低 MDA、Cr、BUN 和钙的水平,从而改善肾功能。
②肾结石患者血浆中的cf-DNA、MPO-DNA、H3Cit和NE浓度升高,DNase I水平降低,肾乳头组织显示 MPO 和 H3Cit 含量增加。血红素和伊红(H&E)染色显示,肾结石患者的肾脏发生了明显的病理变化,包括上皮细胞坏死、肾小管扩张和单核细胞浸润。
③NETs能促进肾结石的形成,从而加重肾损伤。我们的研究发现,NETs 是一种潜在的肾结石诊断和治疗生物标志物。

目的:本研究旨在探讨中性粒细胞胞外诱捕网(NETs)对肾结石的贡献。
方法:应用 GSE73680 微阵列数据和生物信息学分析鉴定肾结石患者的差异表达基因。通过乙二醇和lǜ化铵给药建立了肾结石大鼠模型。收集血浆以检测 cf-DNA、DNase I、MPO-DNA、H3Cit 和 NE。通过生化分析检测超氧化物歧化酶、丙二醛、肌酐、血尿素氮和钙。通过免疫荧光染色检测肾组织中的 MPO、H3Cit 和 NE。细胞凋亡通过 TUNEL 检测进行评估。HE、Periodic Acid-Schiff 和 Von Kossa 染色用于确定肾脏的组织结构、钙沉积和结石形成。对大鼠使用中性粒细胞弹性蛋白酶抑制剂西维来司他钠(西维)以抑制NETs。
结果:共鉴定出 403 个差异表达基因,包括 270 个上调基因和 133 个下调基因。对这些表达失调的基因进行了基因本体富集、KEGG通路和蛋白-蛋白相互作用网络分析。此外,我们还观察到肾结石患者体内 cf-DNA、DNase I、MPO-DNA、H3Cit 和 NE 等 NETs 标志物以及钙沉积物的增加。随后,我们建立了肾结石大鼠模型。我们发现,随着肾结石的发展,肾结石大鼠体内NETs的形成明显升高,肾小管损伤和细胞凋亡加剧。令人震惊的是,我们发现通过西维抑制 NETs 可显著减少钙沉积和细胞凋亡,减轻肾小管损伤,从而改善肾功能。
结论:NETs能促进肾结石的形成,从而加重肾损伤。我们的研究发现,NETs 是一种潜在的肾结石诊断和治疗生物标志物。

肾结石又称泌尿系结石或肾结石,是肾脏中形成的矿物质沉积,有四种类型:钙、尿酸、硬石和胱氨酸,是一种非常常见的泌尿系统疾病,全球约有超过 10%的人患有此病。肾结石可能会导致腰部剧痛、血尿、发烧和发冷,数百年来一直困扰着人类。重要的是,人们注意到肾结石与心血管疾病和慢性肾脏疾病等严重疾病的风险增加有关。肾结石的治疗方法,如肾镜碎石术、冲击波碎石术和经皮肾镜碎石术,已经取得了很大进展。然而,如何预防肾结石复发仍是一个严峻的问题。因此,更好地了解肾结石形成和发展的机制对肾结石的预防和治疗具有重要意义。
中性粒细胞胞外诱捕网(NETs)是由DNA、组蛋白和颗粒蛋白质组成的胞外染色质纤维网。受刺激的中性粒细胞挤出的 NETs 可捕获并杀死入侵的微生物。此外,新的证据显示,NETs 是导致各种疾病的关键因素。例如,Yang 等人发现,结肠癌和乳腺癌患者肝转移灶中的 NETs 形成增加,NETs 通过 CCDC25 吸引肿瘤细胞促进癌症转移。Nakazawa 及其同事报告,NETs 通过释放组蛋白和细胞因子加剧了肾损伤和远处器官功能障碍。NETs 有助于胆结石的形成,但 NETs 参与肾结石的情况仍不清楚。之前的一项研究发现,刷状肾结石中中性粒细胞浸润和 NETs 增加,可能会促进患者的炎症反应,提示其与肾结石有关。
中性粒细胞弹性蛋白酶(NE)是中性粒细胞中富含的一种丝氨酸蛋白酶,具有破坏性弹性蛋白酶的功能,可破坏细胞外基质,调节炎症和组织重塑。NE 在转位到细胞核后会降解组蛋白,并促进 NETs 形成所需的染色质解聚。NE与炎症性疾病、慢性肾脏和肺部疾病有关,而NETs相关的NE在肾结石中的作用尚未见报道。
因此,NETs 与肾结石形成之间的关系是一个谜。揭示NETs参与肾结石的机制加深了人们对肾结石发病机制的认识。在这里,我们证明了NETs在肾结石患者和大鼠体内含量丰富,阻断NETs可抑制肾结石的形成和发展。我们的研究结果为肾结石的发病机制提供了新的见解,并表明靶向NETs可能有益于肾结石的预防和治疗。

1 .肾结石患者体内的失调基因
为了探究肾结石的潜在调控因子,我们分析了GSE73680的芯片数据,发现了403个差异表达基因,其中包括270个上调基因和133个下调基因(图1a)。此外,生物过程术语的 GO 富集分析和 KEGG 通路分析表明,这些差异表达基因与嗅觉信号通路、G alpha (S) 信号事件、细胞外基质降解、细胞外基质组织、GPCR 信号转导、GPCR 下游信号转导、ECM 蛋白多糖和胶原降解密切相关(图 1b,c)。此外,我们将这些差异表达基因提交给 STRING 重建蛋白-蛋白相互作用网络(图 1d),并根据 cytoHubba 插件计算的程度得分确定了前 10 个中心基因,包括 CAV1、TGFB3、FBN1、COL4A2、COL6A1、SERPINH1、SPARC、MMP1、NID1 和 FN1(图 1e)。
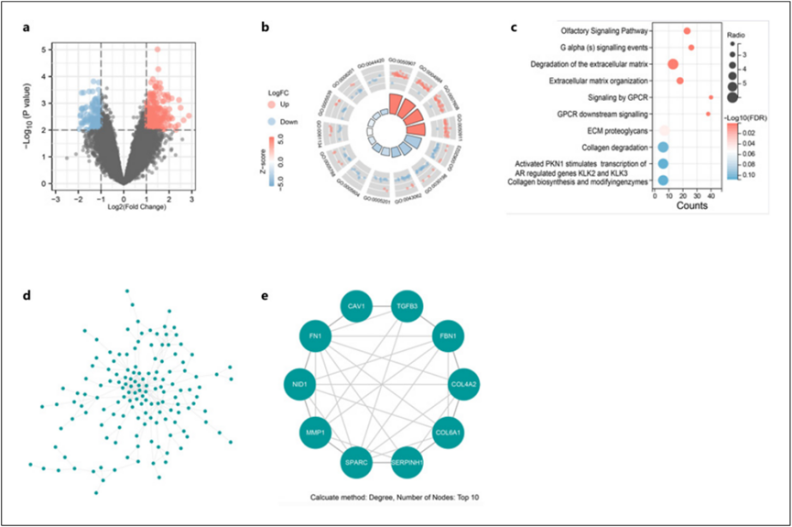
图 1. 肾结石患者的失调基因。a 微阵列数据的火山图;b, c 差异表达基因的 GO 富集和 KEGG 通路分析;d 通过 STRING 构建了 PPI 网络;e 通过 cytoHubba 插件确定了十大枢纽基因。PPI,蛋白质-蛋白质相互作用。
2 .肾结石患者NETs升高
鉴于上述分析表明肾结石涉及细胞外基质的组织和降解,而NETs的重要成分之一NE具有破坏细胞外基质的弹性蛋白酶功能,因此我们的研究重点是探讨NETs在肾结石中的作用。NETs由NE、MPO、cf-DNA和组蛋白(如H3Cit)组成,它是循环cf-DNA的主要来源。因此,为了识别 NETs,我们检测了肾结石患者和遭受外伤需要进行肾切除术的对照组患者血浆中 cf-DNA、DNase I、MPO-DNA、H3Cit 和 NE 的水平。与对照组患者相比,肾结石患者血浆中的cf-DNA、MPO-DNA、H3Cit和NE浓度升高,DNase I水平降低(图2a-e)。此外,肾结石患者的肾乳头组织显示 MPO 和 H3Cit 含量增加(图 2f)。血红素和伊红(H&E)染色显示,肾结石患者的肾脏发生了明显的病理变化,包括上皮细胞坏死、肾小管扩张和单核细胞浸润(图2g)。这些结果表明,NETs 的形成增强,可能与肾结石有关。
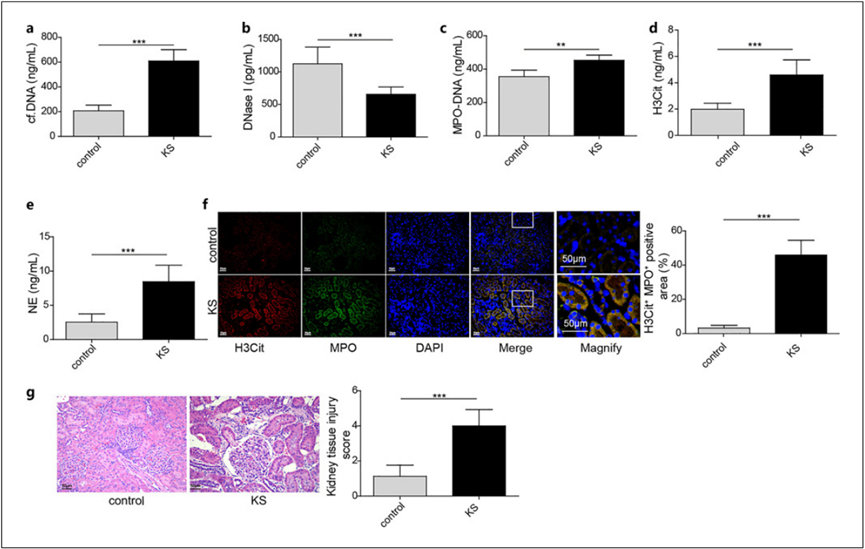
图 2. 肾结石患者的 NETs 升高。a-e 血浆中 cf-DNA、DNase I、MPO-DNA、H3Cit 和 NE 的水平(n = 20);f 肾乳头组织中 H3Cit(红色)和 MPO(绿色)的 IF 染色。g 肾乳头组织的 H&E 染色。**p < 0.01 和 ***p < 0.001。IF,免疫荧光。
-
实验性肾结石大鼠体内NET形成增强
为了评估NETs对肾结石形成和发展的作用,我们通过灌胃乙二醇和lǜ化铵建立了肾结石大鼠模型。实验大鼠的肾脏出现了明显的病理变化,如肾小管扩张和坏死(图 3a)。Von Kossa 和 TUNEL 染色显示肾脏中钙沉积和细胞凋亡明显增加(图 3b、c)。此外,实验性肾结石大鼠肾裂解物中的 SOD 活性降低,MDA 含量增加,血 Cr、BUN 和钙水平升高(图 3d),表明肾结石大鼠的肾功能受损。与对照组大鼠相比,图 1e 中确定的前 10 个基因被证实在肾结石大鼠的肾脏中上调(图 3e)。这些观察结果表明,肾结石大鼠模型已成功建立。
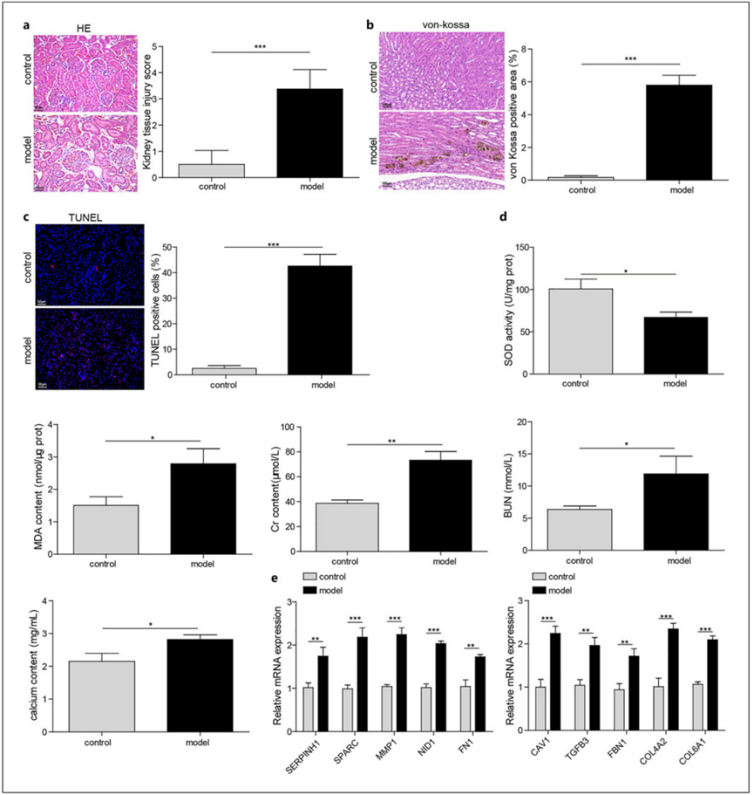
图 3. 通过乙二醇和lǜ化铵给药成功建立了大鼠肾结石模型。a H&E 染色检查肾脏损伤;b Von Kossa 染色测定肾组织中的钙沉积;c TUNEL 染色分析肾组织中的细胞凋亡。e qRT-PCR 分析 CAV1、TGFB3、FBN1、COL4A2、COL6A1、SERPINH1、SPARC、MMP1、NID1 和 FN1 的相对表达。*qRT-PCR,实时定量反转录 PCR。
重要的是,我们发现随着大鼠肾结石的形成,血浆中 cf-DNA、MPO-DNA、H3Cit 和 NE 的水平升高,DNase I 的水平降低(图 4a-e)。此外,H3Cit 和 NE 丰度的增加表明,随着大鼠肾结石的发展,肾脏中 NETs 的形成增强(图 4f)。通过 PAS 和 TUNEL 染色法测定,随着肾结石的形成,肾小管损伤和细胞凋亡明显增强(图 4g,h)。因此,我们的研究结果表明,实验性肾结石大鼠肾脏中的 NETs 数量增加。
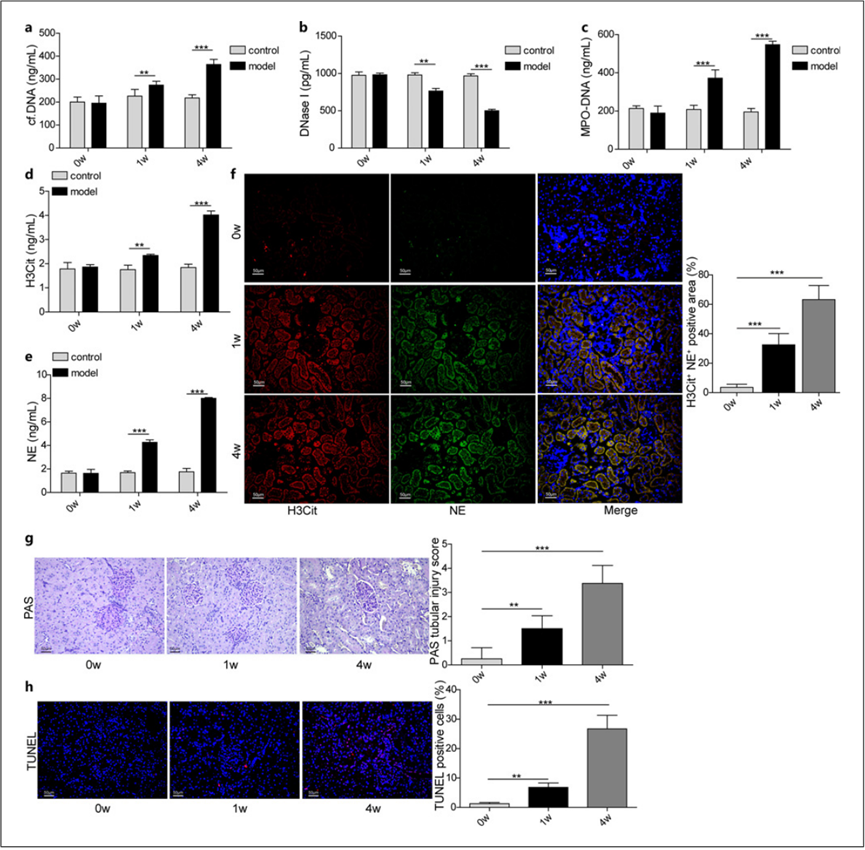
图 4. 实验性肾结石大鼠的 NETs 形成增强。a-e 0 w、1 w 和 4 w 大鼠血浆中 cf-DNA、DNase I、MPO-DNA、H3Cit 和 NE 的水平(n = 8);f 0 w、1 w 和 4 w 肾组织中 H3Cit(红色)和 NE(绿色)的 IF 染色。g PAS 染色检测 0 w、1 w 和 4 w 肾小管损伤情况。 h TUNEL 染色分析 0 w、1 w 和 4 w 肾组织细胞凋亡情况。 **p < 0.01 和 ***p < 0.001。
4 .抑制 NETs 可改善肾结石和肾损伤
此外,通过腹腔注射NET抑制剂西维来司他钠(西维)来抑制肾结石大鼠的NETs,以评估抑制NETs是否会调节肾结石的发生。大鼠分为三组: PBS组、模型 + PBS组和模型 +西维组。使用西维来司他钠后,cf-DNA、MPO-DNA、H3Cit和NE水平升高以及DNase I水平降低的情况得到逆转(图5a-e)。此外,西维还抑制了肾结石大鼠肾脏中 H3Cit 和 NE 表达的增加(图 5f)。这些数据证实了西维能抑制肾结石大鼠体内 NETs 的形成。
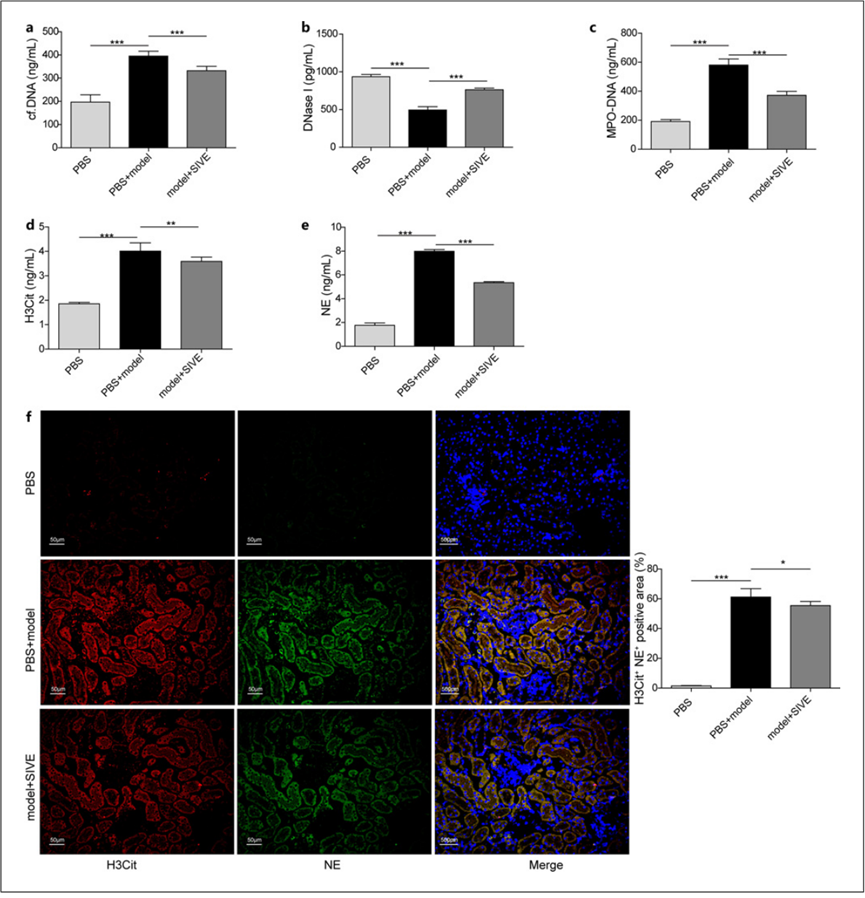
图 5. 通过给大鼠注射西维抑制 NETs。给实验性肾结石大鼠注射西维以阻断 NETs,并将其分为三组:PBS 组、模型 + PBS 组和模型 +西维组: a-e 4 w时大鼠血浆中cf-DNA、DNase I、MPO-DNA、H3Cit和NE的水平(n = 8);f 4 w时肾组织中H3Cit(红色)和NE(绿色)的IF染色;细胞核(蓝色)用DAPI染色。*p < 0.05,**p < 0.01 和 ***p < 0.001。
H&E染色显示,与PBS组相比,模型+PBS组大鼠肾脏检测到肾损伤,而西维明显减轻了肾损伤(图6a)。此外,使用西维后,肾结石大鼠体内增加的钙沉积、凋亡细胞和肾小管损伤均得到改善(图 6b-d)。西维还能提高肾结石大鼠的 SOD 活性,降低 MDA、Cr、BUN 和钙的水平(图 6e),从而改善肾功能。总之,通过西维抑制 NETs 可以抑制肾结石的发展。
- 上一篇:NETs或成为缓解肿瘤复发转移的重要干预靶点
- 下一篇:没有了
相关文章


